Propiedades químicas de la plata

La plata es un elemento químico metálico ampliamente valorado por su versatilidad la cual, es producto de sus propiedades físicas y químicas.
En este post hablaremos sobre las propiedades químicas de la plata que explican el porqué de su valor científico, tecnológico y social ¡No te pierdas ningún detalle!
En la naturaleza la plata se encuentra generalmente cristalizada combinada con otros metales como el antimonio, algunos semimetales como el arsénico y no metales como el azufre y el cloro, escasamente la plata se halla en forma libre como plata nativa.
En cuanto al comportamiento químico de la plata podemos notar que, a pesar de no ser muy activa químicamente, participa en diversas reacciones que le otorgan valor comercial y social. Ver: ¿La plata es un mineral?. Revisemos las más resaltantes.
Oxidación
La plata es muy poco reactiva en presencia del oxígeno por esta razón es ampliamente valorada en las áreas de joyería, sin embargo, cuando se funde puede absorber grandes cantidades de oxígeno que aumentan significativamente su volumen.
A pesar de que la plata es poco reactiva en presencia de oxígeno en presencia de azufre o el sulfuro de hidrógeno del aire reacciona para formar una plata opaca y sin brillo.
Para eliminar este desagradable aspecto, los objetos de plata se pueden sumergir en una disolución de permanganato de potasio o hervir con un poco de ácido clorhídrico concentrado.
Reducción
La plata puede ser reducida formando un espejo de plata característico de un resultado positivo para la presencia de aldehídos en una muestra problema empleando el reactivo de Tollens.
Este reactivo se forma a partir de nitrato de plata acuoso, hidróxido de sodio diluido y disolución amoniacal.
Para formar el “espejo de plata” se le puede añadir al reactivo de Tollens, una disolución de glucosa la cual, ejerce su poder reductor y genera como resultado la obtención de plata metálica que comienza a recubrir la parte interna del recipiente generalmente un tubo de ensayo, formando un espejo de plata.
En lo que respecta al proceso de disolución de la plata se tiene que un ácido oxidante fuerte como el ácido sulfúrico concentrado y caliente puede disolver la plata.
Ver: Configuración electrónica de la plata. De igual manera, el ácido nítrico incluso estando diluido puedo disolverla en su totalidad.
Por otra parte, cabe destacar que la plata metálica no se ve afectada por sales como el clorato de potasio, tampoco reacciona con álcalis cáusticos como el hipoclorito de sodio o hidróxido de sodio.
Otros compuestos que también tienen una acción limitada sobre la plata son los carbonatos alcalinos de sodio, potasio, bario, calcio entre otros.
Sin embargo, puede reaccionar algunos elementos químicos tanto de naturaleza metálica y no metálica formando compuestos de interés comercial como lo veremos a continuación:
Algunos ejemplos de reacciones con metales
Mercurio
La plata puede unirse en frio con el mercurio para formar amalgamas (amalgamas dentales por ejemplo), sin embargo, el proceso térmico favorece sin lugar a duda la unión de ambos elementos.
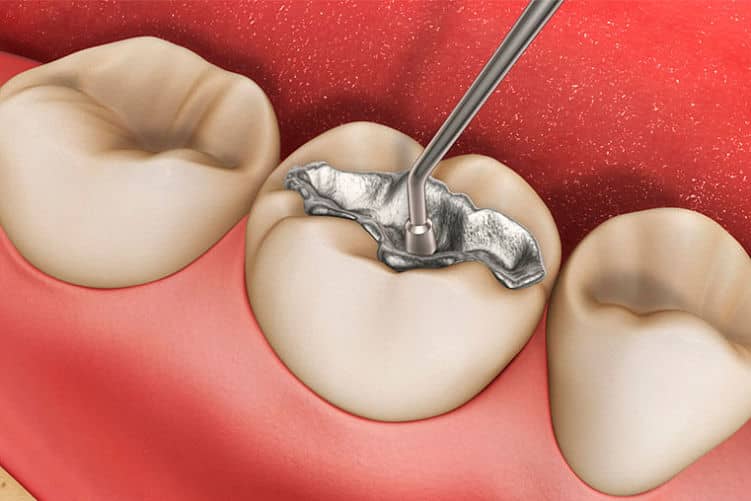
La amalgama plata-mercurio se caracteriza por ser blanda y de color blanco brillante, son usadas con frecuencia en el área de odontología porque la plata aporta componentes antimicrobianos.
Es importante saber que esta combinación ya no se suele utilizar debido a lo peligroso en esta mezcla pues el mercurio es un elemento tóxico para el organismo humano.
Cobre
Las aleaciones metálicas aportan características únicas a sus productos es así como, la adición de cobre metálico a la plata aumenta significativamente su dureza y por tanto su interés comercial.
Ver: Plata 925 ¿Que es?. Esta aleación también es conocida como plata de Ley y se emplea especialmente en la fabricación de piezas de joyería.
Algunos ejemplos de reacciones con no metales
Cloro
El cloruro de plata se obtiene precipitando una sal de plata en presencia de HCl, el precipitado que se obtiene es de color blanco, pero por acción de la luz se oscurece tornándose color negro.
El oscurecimiento de los precipitados es algo relativamente común en los compuestos de plata y esto constituye el principio de la fotografía.
Nitrógeno
Entre los principales compuestos que se forman con nitrógeno y plata encontramos el nitrato de plata, esta es una sal inorgánica caracterizada por su alta solubilidad en agua.

A nivel industrial es muy apreciada entre otros usos por la galvanoplastia la cual, consiste en depositar metales en determinadas superficies haciendo uso de la electricidad.
Esto es posible entre otras cosas gracias a la excelente conducción eléctrica que presenta la plata, la cual es el resultado de la presencia de 1e- en su última capa, según se puede apreciar en su distribución electrónica:
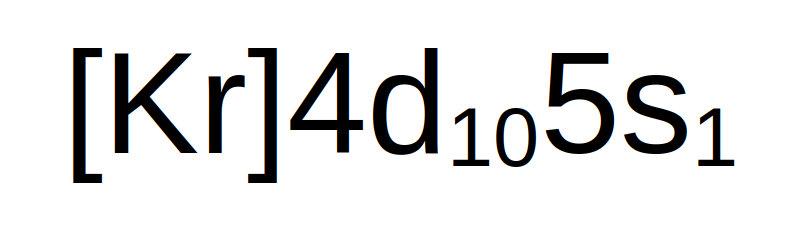
El comportamiento químico de la plata nos permite tener un panorama más claro acerca del porqué este elemento químico es tan versátil y aun desde tiempos antiguos era muy valorado.
Actualmente, gracias a los avances en materia de ciencia y tecnología posiblemente se puedan atribuir a la plata nuevos usos en torno a la solución de problemas industriales, cotidianos e incluso médicos.
Deja una respuesta