Configuración electrónica de la plata
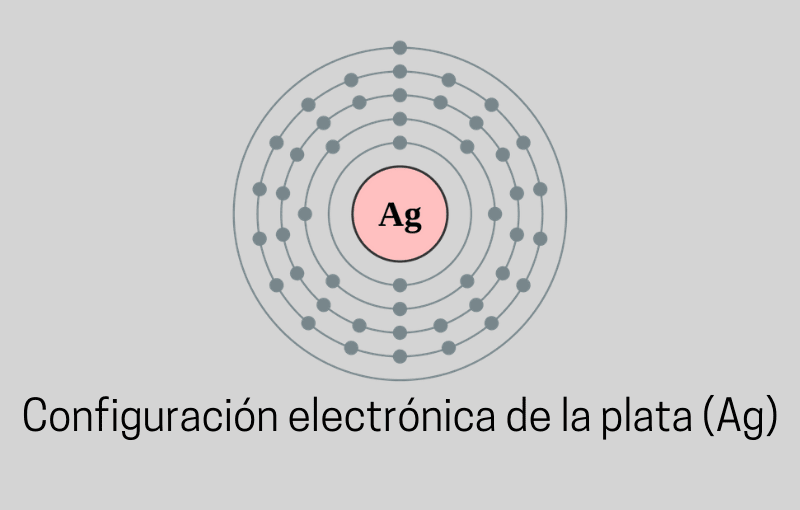
La posición de un elemento en la tabla periódica (número atómico) puede utilizarse para realizar la distribución electrónica y estudiar cómo se organizan los electrones en niveles y subniveles energéticos.
Configuración electrónica de la plata
Algunos elementos introductorios. En un átomo los electrones (e-) carga negativa se mantienen gracias a la atracción que ejerce el núcleo (carga positiva) sobre los mismos.
Es de esperarse que mientras mayor sea la distancia del electrón al núcleo menor será la energía que se requiera para “desprenderlo del átomo”. Ver: ¿Cuánto pesa un lingote de plata?. Es decir, menor será su energía de ionización.
Dicho de otro modo, la energía de ionización se define como la energía que se requiere para extraer un electrón de un átomo gaseoso en estado basal. Esta fue una teoría propuesta por Niels Bohr.
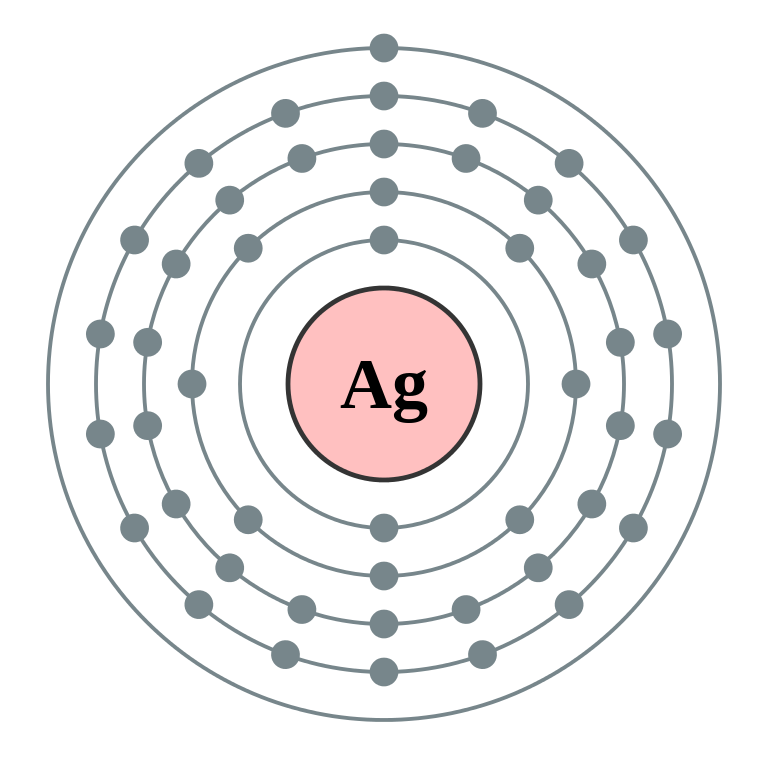
Estudiemos la configuración electrónica de la plata, su número atómico es 47 y su configuración electrónica en el estado natural nos quedaría de esta forma:
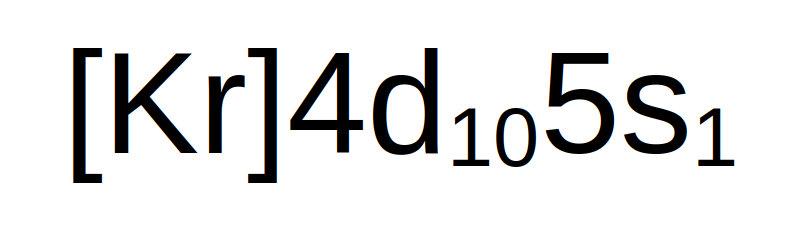
De acuerdo con lo que se puede apreciar en la estructura anterior para la plata alcance la configuración de gas noble (18 e- en su última capa), el átomo de plata tendría que perder 11 electrones (tantos los e- del nivel s como el d) o ganar 7 (para el nivel s).
Ver: Silver Stacking ¿que es?. Cualquier de las dos alternativas requeriría una enorme cantidad de energía lo cual hace que el proceso no sea favorable energéticamente.
Por tanto, lo más esperado es el caso de la plata es que pierda el electrón que se encuentra en el nivel s para adquirir la configuración electrónica externa (configuración en la siguiente imagen) la cual es bastante estable porque contiene 18 e- en su última capa.
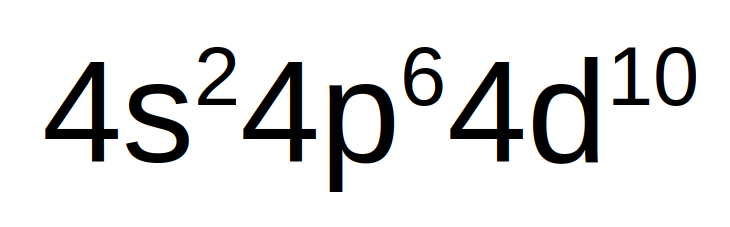
Finalmente, es importante mencionar que los metales de acuñar que forman parte del grupo 11 de la tabla periódica.
Es decir, el cobre, la plata y el oro tienen una configuración electrónica interesante porque tienen el nivel de energía totalmente d lleno con 10 e- y tan 1 e- en nivel s.
Es debido a esta distribución electrónica que los electrones s tienen una excelente movilidad que se traduce en una excelente conducción de la electricidad y del calor para este grupo de elementos químicos.
Deja una respuesta